Teste de avaliação – Estrutura atómica (1)
1. Observa a figura que representa um átomo de lítio. A legenda correta é:
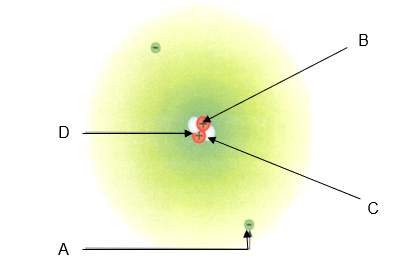
A – Zona de eletrões. B – Neutrão. C – Protão. D – Núcleo.
A – Zona de eletrões. B – Núcleo. C – Protão. D – Neutrão.
A – Protão. B – Neutrão. C – Zona de eletrões. D – Núcleo.
A – Núcleo. B – Neutrão. C – Zona de eletrões. D – Protão.
A – Zona de eletrões. B – Protão. C – Neutrão. D – Núcleo.
2. Faz a associação correta entre os membros da coluna A e os membros da coluna B.
| A | Atomismo. | 1 | A carga positiva dos átomos estaria concentrada no núcleo atómico. | |
| B | Modelo da nuvem eletrónica. | 2 | Os eletrões descreveriam órbitas circulares em torno do núcleo. | |
| C | Modelo atómico de Thomson. | 3 | Cada átomo seria uma porção esférica de matéria mal definida. | |
| D | Modelo atómico de Bohr. | 4 | O átomo seria uma esfera de carga positiva, onde estariam mergulhados eletrões. | |
| E | Modelo atómico de Dalton. | 5 | Orbital – zona do átomo onde se pode encontrar um eletrão com certa energia. | |
| F | Modelo atómico de Rutherford. | 6 | A matéria é feita de pequeníssimos corpúsculos indivisíveis. |
3. Observa as figuras. A legenda correta das figuras é:
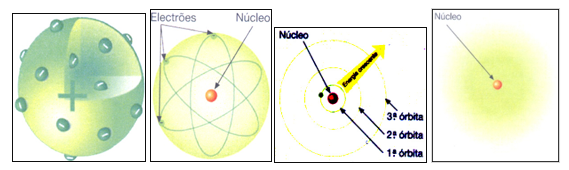
a. A – Modelo atómico de Thomson. B – Modelo atómico de Rutherford. C – Modelo atómico de Bohr. D – Modelo da nuvem eletrónica.
b. A – Modelo atómico de Thomson. B – Modelo da nuvem eletrónica. C – Modelo atómico de Rutherford. D – Modelo atómico de Bohr.
c. A – Modelo atómico de Dalton. B – Modelo da nuvem eletrónica. C – Modelo atómico de Rutherford. D – Modelo atómico de Bohr.
d. A – Modelo atómico de Thomson. B – Modelo da nuvem eletrónica. C – Modelo atómico de Rutherford. D – Modelo atómico de Dalton.
e. A – Modelo atómico de Thomson. B – Modelo atómico de Dalton. C – Modelo atómico de Rutherford. D – Modelo atómico de Bohr.
4. De acordo com o modelo da nuvem eletrónica, podemos afirmar que:
Cada átomo é constituído por um núcleo atómico, que é uma zona central de grandes/ pequenas dimensões.
O núcleo atómico tem carga elétrica negativa /positiva.
Os eletrões ocupam o espaço à volta do núcleo, criando uma zona de carga elétrica positiva /negativa.
Os eletrões de cada átomo não têm/ têm todos a mesma energia e só determinados valores de energia são possíveis.
Uma orbital é uma zona do átomo onde existe menor/ maior probabilidade de se encontrar um eletrão com certa energia.
5. Classifica como verdadeira ou falsa, cada uma das seguintes afirmações:
____ O número atómico corresponde ao número de eletrões existentes no núcleo.
____ O número de massa corresponde ao número de nucleões presentes no átomo.
____ Átomos do mesmo elemento com o mesmo número atómico e diferente número de eletrões dizem-se isótopos.
____ Isótopos são átomos que diferem apenas no número de neutrões no núcleo.
____ Um elemento químico é constituído por átomos com a mesma carga nuclear.
____ Os átomos são eletricamente neutros.
6. Considera a tabela seguinte:
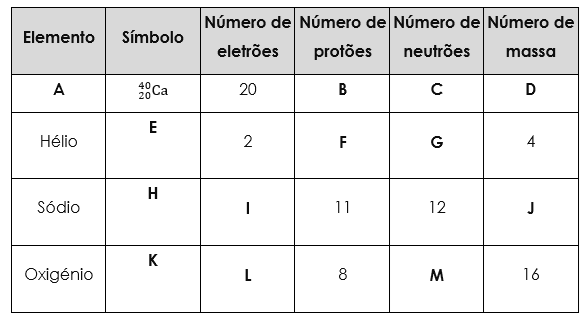
Associa corretamente um nome, um símbolo ou um número a cada uma das letras de A a M.
A – ___________________________________ B – ____________________________________
C – __________________________________ D – ____________________________________
E – __________________________________ F – ____________________________________
G – __________________________________ H – ____________________________________
I – ___________________________________ J – ____________________________________
K – ___________________________________ L – ____________________________________
M – __________________________________
7. Considera a tabela seguinte, onde as letras não correspondem aos verdadeiros símbolos químicos.
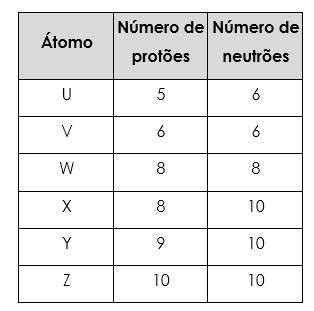
7.1 Quantos elementos químicos estão representados na tabela? Justifica.
7.2 Qual é o número atómico do átomo W?
7.3 Qual é a carga nuclear do átomo Z?
7.4 Qual é o número de massa do átomo X
7.5 Representa esquematicamente o átomo X.
8. Considera a representação esquemática dos núcleos dos átomos de magnésio da figura.
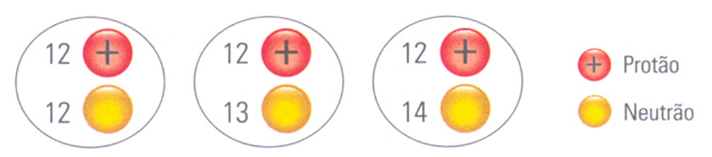
8.1 Indica as semelhanças entre os três núcleos de átomos de magnésio.
8.2 Indica as diferenças entre os três núcleos de átomos de magnésio.
8.3 Classifica estes átomos.
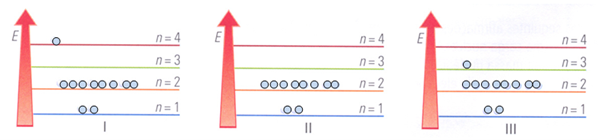
9. Considera um átomo de sódio, com número atómico igual a 11.
Faz a correspondência correta entre os diagramas da figura e a seguinte chave justificando a tua escolha:
a. Átomo de sódio (no estado de menor energia).
b. Átomo de sódio num estado excitado, isto é, estado de maior energia.
c. Ião sódio.
Notas:
- Se tiveres alguma dúvida ou algo que aches que devemos melhorar entra em contacto connosco.
- Se detectares algum erro nos apontamentos, podes reportar através do nosso e-mail – [email protected] porque queremos estar constantemente a melhorar para ti.
- Se queres ver os teus testes e/ou trabalhos expostos na nossa página então podes enviá-los para [email protected].
- Os conteúdos da nossa página vão sendo actualizados porque estamos constantemente a melhorá-la.
Aviso:
O Bem Explicado – Centro de Explicações Lda. é um centro de explicações com sede no concelho de Loures. A nossa página surgiu inicialmente para servir como base de dados de todo o material que fomos elaborando ao longo dos anos mas posteriormente reparamos na grande procura por parte de alunos, professores e encarregados de educação. Surgiu assim uma oportunidade de ajudar todos aqueles que não podiam frequentar o nosso espaço físico, ou por dificuldades financeiras ou pela distância.
O nosso principal objectivo é ajudar-te no teu percurso escolar. Sendo assim disponibilizamos os nossos conteúdos de forma gratuita (até ao 9º Ano) e, para que isso continue a acontecer, agradecemos que não haja qualquer cópia ou reprodução dos conteúdos elaborados pelo “Bem Explicado – Centro de Explicações Lda.” porque isso fará com que este projecto termine.
Sendo assim, agradecemos que colabores connosco para que possamos continuar a ajudar-te neste teu grande percurso!
Bem Explicado – Porque o nosso objectivo é o teu Sucesso escolar!


Add Comment